◆ 新薬情報 index
2014年3月製造販売承認
(印刷用画面へ)■アテディオ配合錠 ■アビガン錠 200mg ■アプルウェイ錠 20mg/デベルザ錠 2… ■イクスタンジカプセル 40mg ■エフィエント錠 2.5mg,3.75mg… ■ザクラス配合錠 LD,HD ■サムスカ錠 30mg ■タペンタ錠 25mg,50mg,100m… ■テノゼット錠 300mg ■テビケイ錠 50mg ■フォシーガ錠 5mg,10mg ■ルセフィ錠 2.5mg,5mg ■ロンサーフ配合錠 T15,T20 ■グラッシュビスタ外用液剤0.03% 5m… ■スミスリンローション5%
■ アビガン錠 200mg
|
| 1. 承認概要 | ||
| 新有効成分 2014年3月 / 2024年8月 発売予定 | ||
| 2. 薬効分類名 | ||
| 抗インフルエンザウイルス薬 | ||
| 3. 一般的名称 | ||
| ファビピラビル | ||
| 4. 適応症 | ||
| 新型又は再興型インフルエンザウイルス感染症(ただし、他の抗 インフルエンザウイルス薬が無効又は効果不十分なものに限る。) 重症熱性血小板減少症候群ウイルス感染症 ※2024年6月適応追加 | ||
| 5. 類薬との比較 | ||
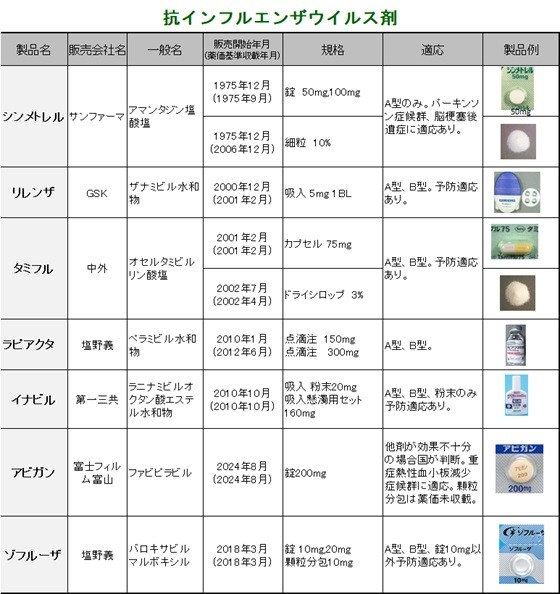 類薬として、タミフル(オセルタミビル)、リレンザ(ザナミビル)、イナビル(ラニナミビル)、 ラピアクタ(ペラミビル)、シンメトレル(アマンタジン)、ゾフルーザ(バロキサビル マルボキシル)があります。 | ||
| 6. 特徴 | ||
| 【特徴】 アビガン錠200mgは、「新型または再興型インフルエンザウイルス感染症」(ただし、他の抗インフルエンザウイルス薬が無効または効果不十分なものに限る)」を 効能・効果とする、政府が備蓄している薬です。 2024年6月に、主にウイルスを持つマダニにかまれることでおきる感染症SFTS=「重症熱性血小板減少症候群」の治療薬として、世界で初めて承認されました。SFTS は、2009 年に中国で初めて発見された新興のウイルス性出血熱で、ブニヤウイルス目フェヌイウイルス科バンダウイルス属に分類される新種のダビエバンダウイルス (SFTSV) の感染によって引き起こされます。通常は感染後 7~14 日間 (平均 9 日間) の潜伏期間を経て発症します。 我が国では4 類感染症に指定されSFTS 患者を診た医師は最寄りの保健所長を経由して都道府県知事への届出が義務付けられています。致死率は国立感染症研究所 (NIID) の報告では 27~31%)と、SFTS は国内の感染症としては極めて致死率が高いことがわかっています。 本剤は、動物実験で胎児に奇形が出るおそれがあることが判明したため、妊婦や妊娠している可能性がある人には使えません。 【背景】 インフルエンザウイルス遺伝子の複製酵素であるRNAポリメラーゼを選択的に阻害し、ウイルスの増殖を阻止します。 新しい作用機序であるため、既存薬への耐性株にも効果を発揮することが見込まれています。 【用法・用量】 <インフルエンザウイルス感染症> 通常、成人にはファビピラビルとして1日目は1回1600mgを1日2 回、2日目から5日目は1回600mgを1日2回経口投与する。総投与期 間は5日間とします。 〈重症熱性血小板減少症候群ウイルス感染症〉 通常、成人にはファビピラビルとして1日目は1回1800mgを1日2 回、2日目から10日目は1回800mgを1日2回経口投与する。総投与 期間は10日間とします。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.妊婦には禁忌です。投与開始前に妊娠検査を行い、陰性であることを確認した上で、 投与を開始します。 この薬の飲み終わりの日から 10 日後までは、性交渉を行わなずもし、 性交渉を行う場合は、パートナーと共に適切な避妊を行うよう指導してください。 「マダニ対策、今できること(国立感染症研究所)」から一部抜粋
| ||
| 8. 製造販売元など | ||
| 製造販売元:富士フイルム富山化学株式会社 【更新】 2024.7.13:重症熱性血小板減少症候群の治療薬として適応追加について加筆、類薬の表を更新 |
(文責 下平秀夫) 2014年6月/2024年7月更新