◆ 新薬情報 index
2015年9月製造販売承認
(印刷用画面へ)■ピートルチュアブル錠250mg,500m… ■イフェクサーSRカプセル37.5mg,7… ■ヴィキラックス配合錠 ■エクメット配合錠LD,HD ■ザガーロカプセル0.1mg,0.5mg ■マリゼブ錠12.5mg,25mg ■ミティキュアダニ舌下錠3300JAU,1… ■スピオルト レスピマット28吸入(,60… ■ゼビアックスローション2% / 油性クリ… ■ロコアテープ
■ ザガーロカプセル0.1mg,0.5mg
|
|
| 1. 承認概要 | ||
| 新効能・新用量 2015年9月 / 2016年6月 発売(薬価未収載) | ||
| 2. 薬効分類名 | ||
| 5α還元酵素1型/2型阻害薬 男性型脱毛症治療薬 | ||
| 3. 一般的名称 | ||
| デュタステリド | ||
| 4. 適応症 | ||
| 男性における男性型脱毛症 | ||
| 5. 類薬との比較 | ||
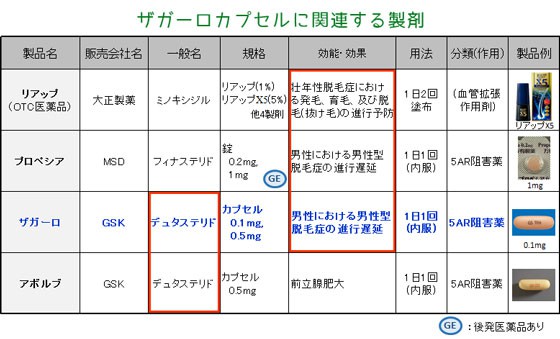 AGAに対する治療薬として、既存薬には医療用医薬品である「プロペシア」とOTC医薬品の「リアップ」があり、本剤は3剤目となります。 本剤の原薬であるデュタステリドは、既承認製剤である「アボルブカプセル 0.5mg」に用いられているものと同一です。 なお、アボルブは前立腺肥大症の治療薬であり、AGAには使用できませんが、万が一、AGAの治療目的で使用された場合には保険給付の対象外であることの周知徹底について、厚生労働省より通知されています。 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は男性における男性型脱毛症(AGA:Androgenetic Alopecia)の治療薬です。前立腺肥大症治療薬「アボルブカプセル」と同じ成分ですが、本剤は生活改善薬ですので保険適応外です。アボルブと識別できるように、軟カプセル剤皮の色が変更されています。既存類薬のプロペシアと同様に5α還元酵素(5AR)阻害薬です。 【背景】 我が国におけるAGAに対する治療は、「男性型脱毛症診療ガイドライン2010年度版」(日本皮膚科学会編)において、薬物療法では医療用医薬品であるプロペシア(フィナステリド)と、OTC医薬品であるリアップ(ミノキシジル)が勧められています。薬物療法で脱毛症が改善しない男性には、毛髪移植や頭皮縮小術等の外科的治療が行われています。AGAは生命に影響を及ぼす身体疾患ではないため、男性型脱毛症に対する治療薬は生活改善薬とみなされています。 【承認状況】 2014年9月現在、AGAの適応としての承認は韓国のみで、日本での発売は世界で2ヵ国目となります。 一方デュタステリド製剤としては、前立腺肥大症の治療薬として 2001年11月に米国で承認されたのをはじめとして、我が国では2009年7月に承認され、2015年6月現在100ヵ国以上で承認されています。 【男性型脱毛症とは 】 日本人成人男性におけるAGA患者は推定1,260万人で、発症頻度は約30%と言われています。AGAは男性において最もよくみられる脱毛の一種で、アンドロゲンにより脱毛が誘発されて進行するものであり、遺伝的素因を有する人に思春期以降に発症します。頭皮の毛包のミニチュア化が進行し、毛周期の成長期が短縮して細く短い毛(軟毛)に置き換わり、最終的には額の生え際が後退し頭頂部の毛髪がなくなります。生命に影響を及ぼす疾患ではありませんが、外見上の印象を大きく左右するため、薄毛に悩む男性の心理的ストレスは強いといわれています。 【作用機序】 アンドロゲンの一種であるテストステロンは、5ARにより活性型のジヒドロテストステロン(DHT)に局所、全身で変換されます。DHTは毛周期の成長期を短縮させます。本剤は5ARを阻害することでDHTの生成を抑制します。 5ARには1型と2型がありますが、フィナステリドが2型のみを抑制するのに対し、本剤は1型と2型の両方の働きを抑えます。 【有効性】 第Ⅱ/Ⅲ相国際共同試験において、プラセボ、デュタステリド(0.02 mg、0.1mg、0.5mg)、フィナステリド1mg を治験対象者合計 917人(日本人200例を含む)が24週間服用したところ、直径 2.54 cm (1 インチ) における発毛数の変化量は、フィナステリドが56.5であるのに対し、デュタステリド0.02 mgでは17.1でしたが、今回承認されたデュタステリド0.1 mgでは63.0(1.1倍)、さらに0.5 mgでは89.6(1.6倍)でした。 【用法・用量】 男性成人には、通常、デュタステリドとして0.1mgを1日1回経口投与します。なお、必要に応じて0.5mgを1日1回経口投与します。 【献血】 本剤は、服用中止後6ヶ月経過しないと献血できません。なおプロペシアは、服用中止後1ヶ月経過しないと献血できません。 (添付文書に記載はありませんが、日本赤十字社のホームページに記載されています) 【副作用】 第Ⅱ/Ⅲ相国際共同試験において、本剤が投与された総症例557例(日本人120例を含む)中、95例(17.1%)に臨床検査値異常を含む副作用が報告されました。比較的発現頻度の高い副作用は、勃起不全24例(4.3%)、リビドー減退22例(3.9%)、精液量減少7例(1.3%)でした(承認時)。 | ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 (1)男性における男性型脱毛症のみの適応です。他の脱毛症に対する適応はありません。また、20歳未満での安全性及び有効性は確立されていません。 (2)妊婦、産婦、授乳婦、小児には禁忌です。特に、妊娠中の女性がデュタステリドを体内に取り込んでしまうと男性胎児の生殖器官等の正常発育に影響を及ぼすおそれがあります。 (3)CYP3A4 阻害作用のあるケトコナゾール等は併用することで血中濃度が上昇するため、注意が必要です。 (4)本剤は、血清前立腺特異抗原(PSA)に影響を与え、投与6ヵ月後にPSA値を約50%減少させるので、前立腺癌等の検査に際しては注意が必要です。 【患者さんへの指導例】 (1)カプセルの内容物が口腔内咽頭粘膜を刺激する場合があるので、服用する際はカプセルは開けたり、噛んだりしないでください。 (2)本剤は経皮吸収されることから、妊婦、産婦、授乳婦、小児がカプセルから漏れた薬剤に触れることのないように保管には十分注意してください。万が一漏れた薬剤に触れた場合には、直ちに石鹸と水で洗ってください。 (3)効果が出る時期には個人差があります。投与開始後12週間で改善が認められる場合もありますが、治療効果を評価するためには、通常6ヵ月間の治療が必要です。 (4)服用中は献血できません。服用中止後も6ヶ月間は献血を避けてください。 | ||
| 8. 製造販売元など | ||
| 製造販売元:グラクソ・スミスクライン株式会社 お問合せ先:グラクソ・スミスクライン株式会社 カスタマー・ケア・センター 0120-561-007 |
(文責 下平秀夫) 2016年1月