◆ 新薬情報 index
2023年3月製造販売承認
(印刷用画面へ)■フルミスト点鼻液 ■ゴービック水性懸濁注シリンジ ■エムパベリ皮下注1080mg ■アポハイドローション20% ■リネイルゲル10% ■ウゴービ皮下注0.25mg,0.5mg,…
■ ゴービック水性懸濁注シリンジ
|
| 1. 承認概要 | ||
| 新有効成分・新医療用配合剤 2023年3月 / 2024年3月 発売(薬価未収載) | ||
| 2. 薬効分類名 | ||
| ワクチン・トキソイド混合製剤 | ||
| 3. 一般的名称 | ||
| 沈降精製百日せきジフテリア破傷風不活化ポリオヘモフィルス b 型混合ワクチン | ||
| 4. 適応症 | ||
| 百日せき、ジフテリア、破傷風、急性灰白髄炎及びインフ ルエンザ菌b型による感染症の予防 | ||
| 5. 類薬との比較 | ||
3種混合ワクチン:ジフテリア+破傷風+百日咳の混合ワクチン 4種混合ワクチン:ジフテリア+破傷風+百日咳+ポリオの混合ワクチン 5種混合ワクチン:ジフテリア+破傷風+百日咳+ポリオ+Hibの混合ワクチン | ||
| 6. 特徴 | ||
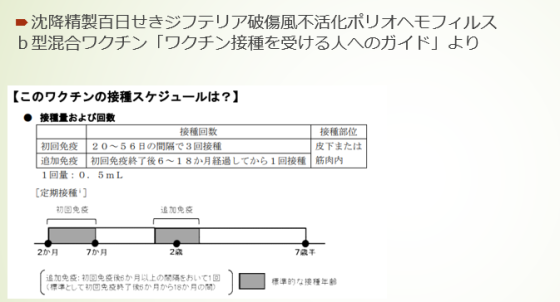
| <特徴> 乳幼児期の定期接種ワクチンとして、「3種混合ワクチン」に加えて、2012年に「4種混合ワクチン」が定期接種に導入されましたが、さらに2023年3月には5種混合ワクチン(ジフテリア+破傷風+百日咳+ポリオ+ヒブ(インフルエンザ菌b型)が承認され、2024年4月より定期接種となります。 乳幼児期のワクチン接種回数が減少することで、乳幼児および保護者の負担軽減が期待されています。 <承認状況> 海外では承認されていません(2023年3月現在)。 <作用機序> ウイルスのタンパク質をつくるもとになる遺伝情報の一部を注射することで、 体内抗体などが体内で作られることにより、ウイルスに対する免疫ができます。 <用法・用量> 初回免疫として、小児に通常0.5mLずつを3回、いずれも20日以上の間隔をおいて皮下または筋肉内に接種します。追加免疫では、初回免疫後6ヵ月以上の間隔をおいて、通常0.5mLを1回皮下または筋肉内に接種します。 <安全性> 国内第III相試験(BK1310-J03)において、皮下接種後の副反応は91.7%に認められました。そのうち、接種部位の主な副反応として、紅斑78.9%、硬結46.6%、腫脹30.1%、疼痛13.5%が認められました。全身性の主な副反応は、発熱(37.5℃以上)57.9%、易刺激性27.1%、過眠症24.1%、泣き23.3%、不眠症13.5%、食欲減退13.5%でした。
| ||
| 7. 使用上の注意と服薬支援 | ||
| <患者さんへの指導例> 1.このワクチンは、5種混合ワクチンです。 2.百日せき、ジフテリア、破傷風、急性灰白髄炎およびHibによる感染症の予防の目的で接種されます。 3.生後2ヵ月から接種を開始し、計4回の定期接種します。 4.発熱(通常37.5℃以上)している場合は接種できません。 5.接種後30分間は接種施設で待機するか、ただちに医師と連絡がとれるようにしておいてください。 6.接種後は健康状態によく気をつけてください。接種部位の異常な反応や体調の変化、高熱、けいれんなどの異常を感じた場合は、すぐに医師の診察を受けてください。 <ここがポイント!> 2011年まで、3種混合ワクチン(ジフテリア+破傷風+百日咳の混合ワクチン)と経口ポリオワクチンが定期接種で使用されていました。 2012年に経口ポリオワクチンから、不活化ポリオワクチンに変更され、同年に、4種混合ワクチン(ジフテリア+破傷風+百日咳+ポリオ)が定期接種に導入されました。 さらに、2023年3月に5種混合ワクチン(ジフテリア+破傷風+百日咳+ポリオ+ヒブ(インフルエンザ菌b型)が承認され、2024年4月より定期接種となります。 ・百日せきは、乳幼児早期から罹患する可能性があり、肺炎や脳症などの合併症を起こし、乳児では死に至る危険性があります。 ・ジフテリアの罹患患者は、1999年以降は日本で確認されていませんが、致死率の高い感染症です。破傷風は、菌が産生する神経毒素によって筋の痙攣・硬直が生じ、治療が遅れると死亡することもあります。 ・急性灰白髄炎(ポリオ)は、脊髄性小児麻痺として知られており、主に手や足に弛緩性麻痺が生じ、永続的な後遺症が残る場合や呼吸困難で死亡することもあります。 ・インフルエンザ菌b型はヒブ(Hib)とも呼ばれ、この菌が何らかのきっかけで進展すると、肺炎、敗血症、髄膜炎、化膿性の関節炎などの重篤な疾患を引き起こすことがあります。いわゆる「インフルエンザ」はインフルエンザウイルスへの感染なのでHibとは全く別のものです。 本剤は、これらの感染症に対する基礎免疫を1剤で同時に付与できるため、乳幼児への注射の負担および薬剤の管理を軽減できるメリットがあります。また、本剤は皮下接種だけでなく、筋肉内接種も可能です。 【臨床試験】 生後2ヵ月以上43ヵ月未満の健康乳幼児267例を対象とした国内第III相試験(皮下接種)において、本剤接種後における初回免疫後の各抗体保有率は、ジフテリアが99.2%、その他は100%であり、追加免疫後はすべて100%でした。追加免疫後では、すべての抗原に対して初回免疫後よりも高い免疫原性を示すことが確認されました。
| ||
| 8. 製造販売元など | ||
| 製造販売元:一般財団法人阪大微生物病研究会 販売元:田辺三菱製薬株式会社 プロモーション提携:ファイザー株式会社 お問合せ先:田辺三菱製薬株式会社 くすり相談センター 0120-753-280 |
(文責 下平秀夫) 2024年3月