◆ 新薬情報 index
2015年7月製造販売承認
(印刷用画面へ)■ランタスXR注ソロスター ■ハーボニー配合錠 ■プラケニル錠200mg ■トルリシティ皮下注0.75mgアテオス/…
■ ランタスXR注ソロスター
|
|
| 1. 承認概要 | ||
| 新剤型 2015年7月 / 2015年9月 発売 | ||
| 2. 薬効分類名 | ||
| 持効型溶解インスリンアナログ製剤 | ||
| 3. 一般的名称 | ||
| 日局インスリン グラルギン(遺伝子組換え) | ||
| 4. 適応症 | ||
| インスリン療法が適応となる糖尿病 | ||
| 5. 類薬との比較 | ||
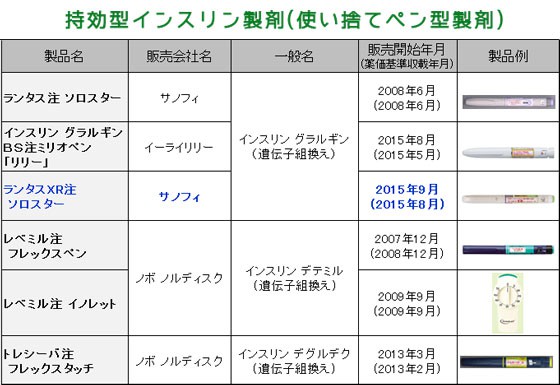 | ||
| 6. 特徴 | ||
| 【特徴】 既存のランタス製剤と同一の成分ですが、濃度を100単位/mLから300単位/mLと3倍にした製剤です。既存製剤より平坦で持続的な薬物動態を示し、24時間以上安定した血糖降下作用を示すと考えられています。 既存製剤に対しては、バイオ後続品として承認されたグラルギンBS注が発売されており、差別化を図った製品と言えます。 【デバイス】 本剤は、インスリンカートリッジが注射器にセットされたプレフィルドタイプの持効型溶解インスリンアナログ製剤で、1~80単位まで1単位きざみで投与量を設定できます。注入抵抗がより少なくなり、高齢者や手の不自由な患者さんでも押しやすい注入器で、1本あたり1.5mL、450単位のインスリンが充填されています。 【ランタスより平坦で持続的な薬物動態】 有効成分濃度を高くし注射液量を少なくすることで、有効成分の吸収がより緩やかになるため、既存製剤よりも持続的な血中濃度および血糖降下作用を示すと考えられています。 バイオ後続品は既存のランタスとの生物学的同等性を確認していますが、ランタスXRソロスターは既存のランタスとは薬物動態が異なるので生物学的に同等とはいえません。 【承認状況】 海外では2015年7月現在、米国、カナダ、欧州で承認されています。 【製剤特性】 インスリングラルギンは、中性のpH領域で低い溶解性を示すように設計されたヒトインスリンアナログで、皮下に投与すると直ちに生理的pHにより微細な沈殿物を形成し、皮下に滞留したこの沈殿物からインスリングラルギンが緩徐に溶解され、皮下から血中に移行します。 【臨床成績】 国内第III相試験において本剤は、100単位/mL製剤と同等の血糖コントロールを示す一方、夜間低血糖および24時間低血糖の患者当たりの年間発現件数が低く、体重増加が小さかったことが示されています。 【用法・用量】 通常、成人では、初期は1日1回4~20単位を皮下注射しますが、ときに他のインスリン製剤を併用することがあります。注射時刻は毎日一定とします。投与量は、患者の症状及び検査所見に応じて増減します。なお、その他のインスリン製剤の投与量を含めた維持量は、通常1日4~80単位です。ただし、必要により上記用量を超えて使用することがあります。 【副作用】 日本人が参加した臨床試験での安全性評価対象日本人症例291例中14例(4.8%)に17件の副作用が認められています。主な副作用は、重篤な低血糖6例(2.1%)及び不眠症、感覚鈍麻、硝子体出血、脂肪肝、全身性そう痒症、注射部位反応、注射部位腫脹、注射部位出血が各1例(0.3%)です(承認時)。その他に、同じインスリングラルギン(遺伝子組換え)注射液である「ランタス注」の市販後において、ショック、アナフィラキシーが報告されています。 【薬価】 1単位当たりに換算すると、ランタスが84.2円、ランタスXRが68.9円でありバイオ後続品の56.5円との薬価差は縮小しています。 | ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 ランタスXRソロスターは、既存のランタスとは薬物動態が異なるので、生物学的に同等とはいえません。ランタスからの切り替え時にはこの点に留意が必要です。 【患者さんへの説明例】 (1)この薬は、持続型のインスリン製剤で血糖値を下げます。 (2)皮下注射は、上腕部、大腿部(だいたいぶ)、腹部、腰部などに行います。同一部位内で注射する場合は前回の注射場所から2~3cm離して注射してください。 (3)高所での作業や自動車の運転等、危険を伴う作業に従事しているときに低血糖をおこすと事故につながるおそれがありますので、特に注意してください。 (4)未使用のランタスXR注ソロスターは、凍結を避けて冷蔵庫(2~8℃)で保管してください。使用開始後は、冷蔵庫に保管せず、光を避けてください。 | ||
| 8. 製造販売元など | ||
| 製造販売元:サノフィ株式会社 お問合せ先:サノフィ株式会社 くすり相談室 0120-109-905 |
(文責 下平秀夫) 2015年12月