◆ 新薬情報 index
2022年11月製造販売承認
(印刷用画面へ)■ゾコーバ錠125mg
■ ゾコーバ錠125mg
|
| 1. 承認概要 | ||
| 新有効成分 2022年11月 / 2022年11月 発売 | ||
| 2. 薬効分類名 | ||
| 抗SARS-CoV-2剤 | ||
| 3. 一般的名称 | ||
| エンシトレルビルフマル | ||
| 4. 適応症 | ||
| SARS-CoV-2 による感染症 ■添付文書 ■患者向医薬品ガイド ■患者さん・患者さんのご家族の方へ | ||
| 5. 類薬との比較 | ||
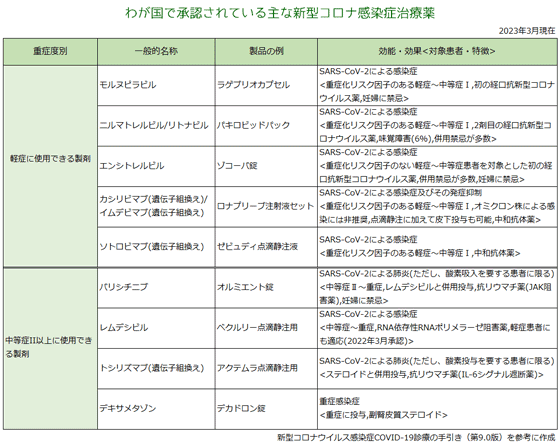 経口薬は3つとなりました。ラゲブリオとパキロビッドは重症化・入院を予防するもの、ゾコーバはリスク因子のない方の症状緩和までの時間を短縮するものです。 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、重症化リスク因子の有無に関わらない軽症~中等症の新型コロナウイルス感染症患者を対象とした初めての抗ウイルス薬であり、発熱、鼻水、喉の痛み、咳などの症状が消失するまでの期間を短くすることが期待されています。 【承認状況】 海外では承認されていません(2022年11月現在)。 【作用機序】 本剤はタンパク質合成過程における3CLプロテアーゼを選択的に阻害することで、新型コロナウイルスの増殖を抑制します。この作用機序は既存類薬のニルマトレルビルと同様です。 【用法・用量】 通常、12歳以上の小児および成人にはエンシトレルビルとして1日目は375mgを、2~5日目は125mgを1日1回経口投与します。SARS-CoV-2による感染症の症状が発現してから速やかに投与を開始する必要があります。 【副作用】 国際共同第IIa相、第IIb相、第III相試験(T1221試験)において、5%以上に認められた副作用は、HDLコレステロール低下(16.6%)でした。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【患者さんへの指導例】 1.この薬は、ウイルスの複製に必要な酵素を阻害することで、新型コロナウイルス感染症の症状を緩和します。発熱、鼻水、喉の痛み、咳などの症状が消失するまでの期間を短くすることが期待されています。 2.初日は1日1回3錠を服用し、2~5日目は1日1回1錠を服用します。 3.体調が良くなっても自己判断で中止せず、指示通りに服用を続けてください。 4.飲み合わせに注意が必要な薬剤が多数ありますので、服用している薬剤や健康食品、サプリメント、嗜好品をすべて申告してください。 5.妊婦または妊娠している可能性がある人はこの薬を使用することはできません。 【ここがポイント!】 新型コロナウイルス感染症の治療で、重症化リスク因子のない軽症~中等症患者を対象とした初めての抗ウイルス薬が登場しました。 投与対象は、高熱、強い咳症状、強い咽頭痛などの臨床症状があり、重症度の高くない患者(おおむね中等症II未満)で、症状発現から遅くとも72時間以内に投与を開始します。初日は3錠を1日1回投与し、2~5日目は1錠を1日1回投与します。 第II/III試験(T1221試験)において、軽症~中等症のSARS-CoV-2感染者に本剤を5日間経口投与したとき、オミクロン株に特徴的な5症状(1.倦怠感または疲労感、2.熱っぽさまたは発熱、3.鼻水または鼻づまり、4.喉の痛み、5.咳)が快復するまでの時間の中央値は、プラセボ群192.2時間に対し本剤群では167.9時間と有意差をもって約1日短縮しました。また、投与4日目のウイルス量は本剤群でプラセボ群に比べて有意に減少しました。 本剤はCYP3Aの基質であり、強いCYP3A阻害作用を有するとともに、P-gp、BCRP、OATP1B1およびOATP1B3阻害作用も有します。このため、併用禁忌薬が多いので、服薬中のすべての薬剤を確認することが必要です。また、本剤で治療中に新たに他の薬剤を服用する場合、事前に相談するよう患者さんに伝えましょう。 ※以下は併用禁忌薬の例で、先発品名で表記しています。 カルブロック,レザルタス配合錠,セララ,テグレトール,リポバス,ベルソムラ,ハルシオン,アレビアチン,リファジン 上記消し線部分は2023.04一般流通後撤廃 上記消し線部分は2023.05.08 第5類感染症に移行後撤廃 患者さんの過度な期待から安易な不適正使用が行われないように、薬剤師は情報提供をしっかりと行うとともに、併用禁忌薬が多いため安全性監視も行っていきましょう。 なお、包装単位は、1箱28錠(14錠PTPシートが2枚)で4人分です。今後は1人分の包装単位も販売されることが期待されます。 【添付文書改訂 2023.05 避妊期間 】 生殖能を有する者に記載されている避妊に関する注意事項の避妊期間が「最終投与後一定期間」→「最終投与後2週間」に変更されました。2023年1月での市販直後調査で禁忌となっている妊婦への投与が2例あったことについて問題となっていました。
| ||
| 8. 製造販売元など | ||
| 製造販売元:塩野義製薬株式会社 お問合せ先:塩野義製薬株式会社 医薬情報センター 0120-956-734 更新 2023.05 .16 一般流通について、第5類への移行について 更新 2023.06 .18 添付文書へのリンク |
(文責 下平秀夫) 2023年3月


