◆ 新薬情報 index
2022年2月製造販売承認
(印刷用画面へ)■パキロビッドパック300、600
■ パキロビッドパック300、600
|
| 1. 承認概要 | ||
| 新有効成分 2022年2月 / 2023年3月 発売 | ||
| 2. 薬効分類名 | ||
| 抗ウイルス剤 | ||
| 3. 一般的名称 | ||
| ニルマトレルビル錠/リトナビル錠 | ||
| 4. 適応症 | ||
| SARS-CoV-2による感染症 | ||
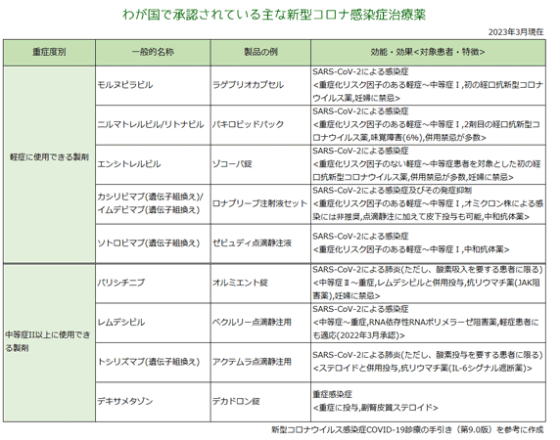
| 5. 類薬との比較 | ||
 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、SARS-CoV-2陽性で重症化リスクを有する軽症~中等症Iの新型コロナウイルス感染症(COVID-19)患者において、臨床的回復までの期間を短縮し、重症化や入院・死亡を予防することが期待されています。 【承認状況】 本剤は、わが国で特例承認されたものであり、承認時における有効性、安全性、品質に係る情報は限られているため、引き続き情報を収集する必要があります。そのため、本剤の使用に当たっては、あらかじめ患者又は代諾者に、その旨並びに有効性及び安全性に関する情報を十分に説明し、文書による同意を得てから投与することになっています。 【作用機序】 ニルマトレルビルは新型コロナウイルスの増殖に関わるメインプロテアーゼの作用を阻害して抗ウイルス効果を発揮します。リトナビルは抗HIV薬としても用いられている強力なCYP3A阻害薬であり、ニルマトレルビルの濃度を上げるブースター薬として働きます。 【用法・用量】 通常、成人および12歳以上かつ体重40kg以上の小児には、ニルマトレルビルとして1回300mgおよびリトナビルとして1回100mgを同時に1日2回、5日間経口投与します。 中等度の腎機能障害患者(30mL/min≦eGFR<60mL/min)の場合には、ニルマトレルビルとして1回150mgおよびリトナビルとして1回100mgを同時に1日2回、5日間経口投与します。重度の腎機能障害患者(eGFR<30mL/min)への投与は推奨されていません。 なお、SARS-CoV-2による感染症の症状が発現してから速やかに本剤の投与を開始することが望ましく、臨床試験において症状発現から6日目以降に投与を開始した患者における有効性を裏付けるデータは得られていません。 【副作用】 国際共同第II/III相試験の中間解析時点で認められた副作用は672例中49例(7.3%)で、主なものは味覚不全25例(3.7%)、下痢13例(1.9%)、高血圧(頻度不明)などでした。 なお、重大な副作用として中毒性表皮壊死融解症(TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、肝機能障害(いずれも頻度不明)が設定されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.用法は、1日2回5日間の経口投与です。2023年3月に薬価収載された「パキロビッドパック600」は、シート1枚が1日分となっており、1回にニルマトレルビル錠を2錠およびリトナビル錠を1錠投与します。 2.重度の腎機能障害患者には禁忌となっており、同じく2023年3月に薬価収載された「パキロビッドパック300」は、中等度の腎機能障害患者に対してニルマトレルビル錠を1回1錠に減量して投与します。 3.リトナビルはCYP3Aを強く阻害し、またニルマトレルビルおよびリトナビルはCYP3Aの基質となっています。そのため、併用に注意すべき薬剤が多数あり、併用禁忌薬としてはフレカイニド、アミオダロン、ピモジド、ピロキシカム、アゼルニジピン、リバーロキサバン、ジアゼパム、エスタゾラム、フルラゼパム、トリアゾラム、ボリコナゾールなど38成分とセイヨウオトギリソウが挙げられています。 4.上記以外にも注意すべき薬剤はあると考えられており、国立国際医療研究センター病院が国内外の資料を基に作成した「パキロビッドパックとの併用に慎重になるべき薬剤リスト」を公開しています。 【有効期限24カ月に延長】 2023.2加筆 本剤の有効期限は2022年9月に12カ月から18カ月に延長され、さらに追加の安定性試験の結果を踏まえて、2023年2月に24カ月に延長されました。厚労省は2023年2月10日に事務連絡「パキロビッドパックの使用期限の取扱いについて」において、新型コロナウイルス感染症治療薬は貴重な薬剤であり、有効活用の観点から既存の「有効期限12か月」として使用期限が印字されている製剤についても、「有効期限24か月」として取り扱うことを認めると通知しました。 【併用禁忌からフルカム、バキソが削除】 2023.9加筆 2023年8月の添付文書改訂により、本剤の併用禁忌から「アンピロキシカム(フルカム)、ピロキシカム(バキソ、フェルデン)、リオシグアト(アデムパス) 」が削除され「リオシグアト 」が併用注意に変更されています。 【患者さんへの指導例】 1.この薬は、新型コロナウイルスの増殖に必要な酵素を阻害する抗ウイルス薬と、この抗ウイルス薬の分解を抑えて血中濃度を維持する薬の2種類がセットになっています。 2.食事の有無にかかわらず、朝と夕の1日2回、12時間ごとに服用してください。症状が改善しても指示どおりに5日分を飲み切ってください。 3.飲み合わせに注意が必要な薬剤が多数ありますので、服用している薬剤や健康食品、サプリメント、嗜好品をすべて報告してください。 4.服薬開始後、疲れやすい、体がだるい、力が入らない、吐き気、食欲不振などの症状のほか、異常が現れた場合はすぐに相談してください。 【ここがポイント!】 本剤は、COVID-19に対する抗ウイルス薬として特例承認されました。経口薬としては、2021年12月に特例承認されたモルヌピラビル(商品名:ラゲブリオカプセル)に続く2剤目の薬剤となります。 セットとなっている2剤のうち、ニルマトレルビルは新型コロナウイルスの増殖に関わるメインプロテアーゼの作用を阻害して抗ウイルス効果を発揮し、リトナビルは抗HIV薬としても用いられている強力なCYP3A阻害薬であり、ニルマトレルビルの濃度を上げるブースター薬として働きます。 主な治療対象は、モルヌピラビルと同様に重症化リスクの高い軽症~中等症Iの患者ですが、本剤は12歳以上(体重40kg以上の場合)から服用できます。 軽症患者を対象とした薬剤は本剤のほかに、中和抗体製剤カシリビマブ/イムデビマブ(同:ロナプリーブ注射液セット)と、ソトロビマブ(同:ゼビュディ点滴静注液)の2剤が承認されています。また、2022年3月にレムデシビル(同:ベクルリー点滴静注用)も軽症患者に適応追加となりました。 わが国も参加している国際共同第II/III相EPIC-HR試験の結果において、症状発現から3日以内に本剤の投与を受けた患者では入院・死亡リスクが89%減少し、5日以内に投与を受けた患者では88%減少しました。なお、各変異株に対する臨床試験の有効性データは現時点では得られていませんが、in vitroにおいてはオミクロン株ほか懸念すべき変異株に対する抗ウイルス効果が認められています。 当初、本剤を使用する医療機関は、ファイザーが開設する「パキロビッドパック登録センター」に登録して配分依頼を行っていましたが、2023年3月より薬価収載され、一般流通となりました。処方に際しては患者の同意書が必要であり、院外処方に際しては、対応薬局に処方箋とともに記入済みの「投与前チェックシート」を提出する必要があります。 処方箋を応需した薬局薬剤師は、とくに併用薬に注意すべきであり、服薬中のすべての薬剤を確認しなければなりません。また、腎機能に応じて適切な投与量になっているかどうかのチェックも行いましょう。
| ||
| 8. 製造販売元など | ||
| 2023年2月 更新 <有効期限の延長> 2023年3月 更新 <類薬の図を更新><パキロビッドパック 600/300追加と、一般流通開始について> 2023年9月 更新 【併用禁忌からフルカム、バキソが削除】加筆 製造販売元:ファイザー株式会社 お問合せ先:ファイザー株式会社 製品情報センター 0120-664-467 |
(文責 下平秀夫) 2022年3月/2023年9月更新