◆ 新薬情報 index
2020年7月製造販売承認
(印刷用画面へ)■シルガード9水性懸濁筋注シリンジ
■ シルガード9水性懸濁筋注シリンジ
|
| 1. 承認概要 | ||
| 新有効成分 2020年7月 / 2021年2月 発売(薬価未収載) | ||
| 2. 薬効分類名 | ||
| ウイルスワクチン類 | ||
| 3. 一般的名称 | ||
| 組換え沈降 9 価ヒトパピローマウイルス様粒子ワクチン(酵母由来) | ||
| 4. 適応症 | ||
| ヒトパピローマウイルス 6、11、16、18、31、33、45、52 及び 58型の感染に起因する以下の疾患の予防 ・子宮頸癌(扁平上皮細胞癌及び腺癌)及びその前駆病変(子宮頸部上皮内腫瘍(CIN)1、2 及び 3 並びに上皮内腺癌(AIS)) ・外陰上皮内腫瘍(VIN)1、2 及び 3 並びに腟上皮内腫瘍(VaIN)1、2 及び 3 ・尖圭コンジローマ | ||
| 5. 類薬との比較 | ||
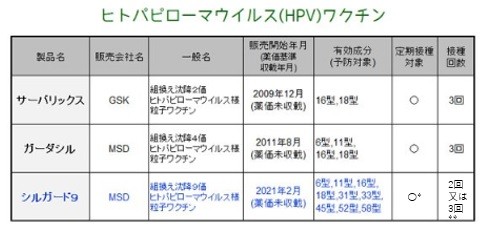 *2023.4から定期接種(無料化) **20233.3より9歳~14歳の2回接種が可能となった | ||
| 6. 特徴 | ||
【特徴】 本剤は、子宮頸がんなどの原因となる7つのヒトパピローマウイルス(HPV)型と、尖圭コンジローマなどの原因となる2つのHPV型の感染を予防する9価のHPVワクチンです。 【承認状況】 海外では、2014年12月に米国で承認されて以降、80以上の国と地域で承認されています(2020年7月現在)。 【作用機序】 本剤は、HPVのL1タンパク質からなるウイルス様粒子(VLP)を含有する不活性化ワクチンの一つであり、接種することで液性免疫を惹起し、有効性を示します。 【用法・用量】 9歳以上の女性に、1回0.5mLを合計3回(2回目は初回接種の2ヵ月後、3回目は6ヵ月後)、筋肉内に注射します。1年以内に3回の接種を終了することが望ましいですが、2回目は初回から少なくとも1ヵ月以上、3回目は2回目から少なくとも3ヵ月以上の間隔を置いて接種することとされています。 9歳以上15歳未満の女性は、初回接種から6~12ヵ月の間隔を置いた合計2回の接種とすることができます。(2023.03改訂)9歳以上15歳未満の女性に合計2回の接種をする場合、13ヵ月後までに接種することが望ましいとされています。 なお、医師が必要と認めた場合には、他ワクチンと同時に接種することができますが、本剤と他ワクチンを混合して接種することはできません。 【副作用】 日本人を含む後期第II相/第III相国際共同試験(001試験)において、注射部位の副反応は、本剤接種後5日間で7,071例中6,414例(90.7%)に認められ、主なものは疼痛6,356例(89.9%)、腫脹2,830例(40.0%)、紅斑2,407例(34.0%)、そう痒感388例(5.5%)、内出血137例(1.9%)、腫瘤90例(1.3%)、出血69例(1.0%)でした。また、全身性の副反応は、本剤接種後15日間で7,071例中2,090例(29.6%)に認められ、主なものは頭痛1,033例(14.6%)、発熱357例(5.0%)、悪心312例(4.4%)、浮動性めまい211例(3.0%)、疲労166例(2.3%)、下痢87例(1.2%)、口腔咽頭痛73例(1.0%)、筋肉痛69例(1.0%)でした。 日本人を対象とした国内第III相臨床試験(008試験)では、注射部位の副反応は、本剤接種後5日間で100例中95例(95.0%)に認められ、主なものは疼痛93例(93.0%)、腫脹42例(42.0%)、紅斑33例(33.0%)、そう痒感4例(4.0%)、出血3例(3.0%)、熱感3例(3.0%)でした。また、全身性の副反応は、本剤接種後15日間で100例中14例(14.0%)に認められ、主なものは発熱3例(3.0%)、頭痛2例(2.0%)、悪心2例(2.0%)、感覚鈍麻2例(2.0%)、腹痛2例(2.0%)でした。 なお、重大な副作用として、過敏症反応(アナフィラキシー、気管支痙攣、蕁麻疹)、ギラン・バレー症候群、血小板減少性紫斑病、急性散在性脳脊髄炎(ADEM)(いずれも頻度不明)が設定されています。国内外の臨床試験における安全性検討対象1万3,408例では、過敏症3例および蕁麻疹20例が副反応として報告されています。ギラン・バレー症候群、血小板減少性紫斑病およびADEMは臨床試験において認められていませんが、本剤と同一の有効成分を含むワクチン(商品名:ガーダシル)と同様に設定されました。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.明らかな発熱を呈している方には使用できません(禁忌)。 2.被接種者またはその保護者に、接種当日は過激な運動は避け、接種部位を清潔に保つよう指導しましょう。 【患者さんへの指導例】 1.ワクチン接種により、子宮頸がんや尖圭コンジローマなどの原因となる9つのHPV型に対する抗体ができ、今後の感染を予防します。 2.接種後に血管迷走神経反射として失神が現れることがあります。接種後30分程度は、背もたれや肘掛けのある安全ないすに座っていてください。 3.本剤接種後に、注射部位だけでなくほかの部位に激しい痛み(筋肉痛、関節痛、皮膚の痛みなど)やしびれ、脱力などが現れて長時間持続する場合は、速やかに医師に相談してください。 【ここがポイント!】 わが国において、年間約1万人が子宮頸がんに罹患し、毎年約2,900人が死亡しています。患者数・死亡者数ともに近年増加傾向にあり、子宮頸がん発症のピークが出産年齢と重なることが問題となっています。子宮頸がんの95%以上はHPV感染が原因で、感染経路は主に性的接触です。性交渉の経験がある女性のうち、50~80%が生涯で一度以上の感染を経験すると推計されていて、そのうちの一部が将来的に高度前がん病変や子宮頸がんを発症します。 本剤は、わが国で3番目に発売されたHPVワクチンです。いずれの製剤も筋肉内注射で、計3回接種が必要な不活性化ワクチンです。既存薬の1つである2価ワクチン(商品名:サーバリックス)は、子宮頸がんの主な原因となるHPV16型と18型の感染を予防します。もう1つの既存薬である4価ワクチン(同:ガーダシル)は、上記に加えて尖圭コンジローマなどの原因となる6型と11型の感染も予防します。4価ワクチンは、2020年12月に男性も接種が可能となりました(公費助成の対象外)。 本剤は、前述の4つのHPV型に加えて、31型・33型・45型・52型・58型の5つのHPV型のウイルス様粒子も含有する9価ワクチンであり、約90%の子宮頸がんを予防することが期待されています。 既存2剤は定期接種の対象で、小学6年生~高校1年生相当の女子は公費助成によって無料で接種を受けることができますが、本剤は任意接種でした。2023年4月から本剤について定期接種(無料化)となりました。 HPVワクチンは、今後のHPVの感染を予防するものであり、すでにHPVに感染している細胞からのウイルス排除や進行抑制には効果はありません。したがって、性交渉を経験する前に接種することが最も効果的ですが、性交渉の経験があっても、予防対象のHPV型に感染していなければ効果が期待できます。 HPVワクチンについては、過去に疼痛や運動障害などの副反応が大きく報道され、2013年6月に厚生労働省より「積極的な勧奨の一時差し控え」が発表されました。世界では接種完遂率が80%を超える国もある中、わが国の接種率は0.3%と非常に低い水準にとどまっています。 一方で、2017年11月に厚生労働省専門部会は、HPVワクチン接種後に報告された多様な症状とHPVワクチンとの因果関係を示す根拠は報告されていないと発表しています。近年、国が地方自治体に定期接種対象者への周知を徹底するよう求めるなど、接種率向上に向けた動きがみられています。 ■9価ヒトパピローマウイルス(HPV)ワクチン(シルガード9)について(厚生労働省) ■小学校6年 ~ 高校1年 の女の子と保護者の方へ9価の「HPVワクチン」を公費で接種できるようになりました ■平成9年度生まれ~平成18年度生まれまでの女性へ「HPVワクチン」 の接種の機会を逃した方も 9価のワクチンを公費で 接種できるようになりました
| ||
| 8. 製造販売元など | ||
| 製造販売元:MSD株式会社 お問合せ先:MSD株式会社 MSDカスタマーサポートセンター 0120-024-961 【更新】2023.4 2回接種、定期接種化について記載 |
(文責 下平秀夫) 2021年6月