◆ 新薬情報 index
2018年2月製造販売承認
(印刷用画面へ)■ゾフルーザ錠10mg,20mg,顆粒剤
■ ゾフルーザ錠10mg,20mg,顆粒剤
|
| 1. 承認概要 | ||
| 新有効成分 2018年2月 / 2018年3月 発売 | ||
| 2. 薬効分類名 | ||
| 抗インフルエンザウイルス剤 | ||
| 3. 一般的名称 | ||
| バロキサビル マルボキシル | ||
| 4. 適応症 | ||
| 〈ゾフルーザ錠 20mg、ゾフルーザ顆粒 2%分包〉 A型又は B型インフルエンザウイルス感染症の治療及びその予防 〈ゾフルーザ錠 10mg〉 A型又は B型インフルエンザウイルス感染症 | ||
| 5. 類薬との比較 | ||
 現在国内で販売されているインフルエンザ治療薬のタミフルカプセル、リレンザ吸入、イナビル吸入、ラピアクタ点滴静注は、いずれもノイラミニダーゼ阻害薬です。本剤は作用機序が異なり、一定要件を満たす革新的新薬として2015年10月、厚労省から先駆け審査指定制度の対象品目に指定されました。 なお、2014年3月に新しい作用機序のRNAポリメラーゼ選択的阻害薬アビガン(ファビピラビル)が「新型又は再興型インフルエンザウイルス感染症(ただし、他の抗インフルエンザウイルス薬が無効又は効果不十分なものに限る)」という適応で承認されていますが、現時点でパンデミック発生時などに使用すると国が判断した場合にのみ、患者への投与が検討されます。 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は初めての1回飲み切りの錠剤で、良好なアドヒアランスが期待できます(既存の飲み薬であるタミフルカプセル・ドライシロップの場合には、治療に1日2回、5日間の服用が必要です)。また、既存薬がノイラミニダーゼ阻害薬であるのに対し本剤はそれと異なる作用機序です。成人、及び本剤を適正に服用できれば体重が10kg以上の小児・幼児にも使用できます。 2018年9月に顆粒剤が承認されましたが、2024年7月現在発売されていません。 2020年11月に予防の適応が追加となりました。 【承認状況】 海外では発売されていません。(2018年2月時点) 【作用機序】 本薬はプロドラッグであり、体内で小腸、血液、肝臓中のエステラーゼによって速やかに加水分解され、バロキサビル マルボキシル活性体に変換されます。本活性体はmRNAの合成開始に関与するキャップ依存性エンドヌクレアーゼを阻害し、細胞内でのウイルス増殖を抑えます。ノイラミニダーゼ阻害薬と比較し作用機序の観点からウイルスの増殖後も効果が期待できる可能性があります。 【臨床効果】 国際共同第III相臨床試験において、インフルエンザの各症状(咳,喉の痛み,頭痛,鼻づまり,熱っぽさ又は悪寒,筋肉又は関節の痛み,並びに疲労感)の全ての症状が「なし」または「軽度」に改善するまでの時間と定義した「インフルエンザ罹病期間」は、プラセボ群は80.2時間、本剤投与群は53.7時間でした。ウイルス排出停止までの時間(中央値)は、タミフル群が72.0時間に対し、ゾフルーザ群は24.0時間と有意に短縮されており、家庭内感染をより防ぐ可能性が期待されます。ノイラミニダーゼ阻害耐性ウイルスに対する抗ウイルス作用も確認されています。 【用法・用量】 <錠剤> 1.通常、成人及び12歳以上の小児には、20mg錠2錠を単回経口投与します。ただし、体重80kg以上の患者さんには20mg錠4錠を単回経口投与します。 2.通常、12歳未満の小児には、以下の用量を単回経口投与します。 体重:40kg以上 ーーーーーーーー 用量:20mg錠2錠 体重:20kg以上40kg未満 ーーー 用量:20mg錠1錠 体重:10kg以上20kg未満 ーーー 用量:10mg錠1錠 【副作用】 成人及び12歳以上の小児を対象とした臨床試験における安全性評価対象例910例中、臨床検査値の異常変動を含む副作用は49例(5.4%)に認められました。主なものは、下痢12例(1.3%)、ALT(GPT)増加8例(0.9%)でした。(承認時) 12歳未満の小児を対象とした臨床試験における安全性評価対象例105例中、臨床検査値の異常変動を含む副作用は4例(3.8%)に認められました。主なものは、下痢2例(1.9%)でした。(承認時) なお、2019年3月に「重大な基本的注意」に血便、吐血、不正子宮出血等の出血症状について注意するよう指示されました。 | ||
| 7. 使用上の注意と服薬支援 | ||
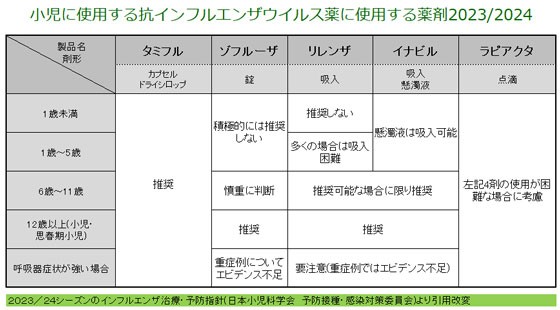
| 【薬剤師への注意】 (1)抗ウイルス薬の投与はA型又はB型インフルエンザウイルス感染症の全ての患者に対して必須ではありません。 (2)小児に対しては、本剤を適切に経口投与できると判断された場合にのみ投与します。 (3)既存の抗インフルエンザウイルス剤と同様に症状発現後可能な限り速やかに開始することが望ましく、症状発現から48時間経過後に投与を開始した場合の有効性を裏付けるデータはありません。 (4)因果関係は不明ですが、抗インフルエンザウイルス薬投薬後に異常行動等の精神・神経症状を発現した例が報告されています。このため、既存の抗インフルエンザウイルス剤と同様に小児・未成年者については異常行動による転落等の万が一の事故を防止するための予防的な対応が必要です。 【患者さんへの指導例】 (1)インフルエンザウイルスに作用してウイルスの増殖をおさえます。 (2)異常行動の発現のおそれがあるので、自宅において療養を行う場合、少なくとも治療開始後2日間は小児・未成年者が一人にならないよう、保護者等は配慮してください。 (3)授乳は避けてください。 【ここがポイント!】 本剤の最大の利点は、1回のみの服用で済むため服薬アドヒアランスの向上が見込めるということで、服薬指導も簡単です。また、オセルタミビル(タミフル)よりも治療後2~3日のウイルス力価が下がるということもあげられます(症状の改善までの期間は違いなし)。一方、懸念材料としては、耐性ウイルスの発現率が高いことがあげられます。 本剤は耐性ウイルスの問題で、2018年に発売されて以降、小児では推奨されていませんでした。2022/23 シーズンの治療・予防指針でも、「今後のさらなるデータの蓄積と検証が望ましいと考え、現時点では 12 歳未満の小児に対する同薬の積極的な投与を推奨しない」とされていました。 しかし、2023年11月19日に公表された「2023/24 シーズンのインフルエンザ治療・予防指針」では、他の経口抗インフルエンザ薬と同様に、バロキサビルが12歳以上で推奨されるようになりました。 | ||
| 8. 製造販売元など | ||
| 製造販売元:塩野義製薬株式会社 お問合せ先:塩野義製薬株式会社 医薬情報センター 0120-956-734 【更新】 2024.7.12:「2023/24シーズン治療・予防」について加筆,[類薬との比較表]を更新,ゾフルーザ顆粒の剤形追加(未発売) |
(文責 下平秀夫) 2018年3月/2024年7月更新